불균등화 반응 (Disproportionation reaction)
불균등화 반응이라는 것은 산화환원반응에서 어떠한 물질이 산화가 되면서 동시에 환원이 되고, 이에 따라 각기 다른 생성물을 만드는 반응을 말합니다. 산화와 환원이 동시에 일어나기 때문에 산화환원반응(redox)으로 간주되는데, 반응식에서 산화수(oxidation number, oxidation state)가 3개 이상이 되는 원소가 있다면 불균등화 반응에 해당이 됩니다. 말로 하는 단순 설명으로는 잘 이해하기 어려울 수가 있으니 아래와 같이 사례를 통해서 정리해 보겠습니다.
과산화수소가 분해되어 물과 산소를 생성하는 반응
과산화수소의 분해로 물과 산소가 생성되는 반응은 촉매가 없어도 자연히 반응이 진행되나, 반응속도가 매우 느립니다. 따라서 효소인 카탈레이스(catalase)나 이산화망가니즈(MnO2)를 촉매로 사용하여 반응 속도를 높이게 됩니다.
2H2O2 → 2H2O + O2
여기서 산소의 산화수를 살펴보면 아래와 같이 됩니다.
- H2O2에서 O의 산화수 : -1
- H2O에서 O의 산화수 : -2, O의 산화수가 -1에서 -2로 감소하였으므로 환원되었습니다.
- O2에서 O의 산화수 : 0, O의 산화수가 -1에서 0으로 증가하였으므로 산화되었습니다.
따라서, 이 반응에서 과산화수소(H2O2)는 산화수의 증감에 따라서 산화되기도, 환원되기도 합니다.

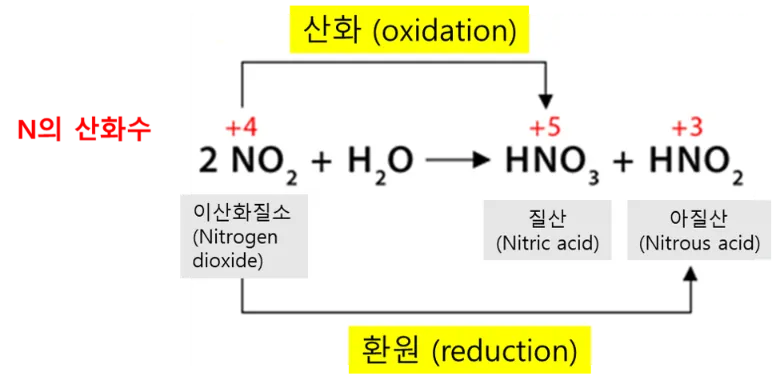
이산화질소와 물의 반응
이산화질소(NO2)가 물과 만나면 아질산(HNO2)과 질산(HNO3)을 생성합니다. 이는 산성비의 원인이 되는 반응식에도 등장을 하는데요, 반응식은 아래와 같습니다.
2NO2 + H2O → HNO2 + HNO3
이 반응에서 질소의 산화수를 살펴보면 아래와 같이 됩니다.
- NO2에서 N의 산화수 : +4
- HNO2에서 N의 산화수 : +3, 따라서 N의 산화수가 +4에서 +3으로 감소하였으므로 환원되었습니다.
- HNO3에서 N의 산화수 : +5, 따라서 N의 산화수가 +4에서 +5로 증가하였으므로 산화되었습니다.
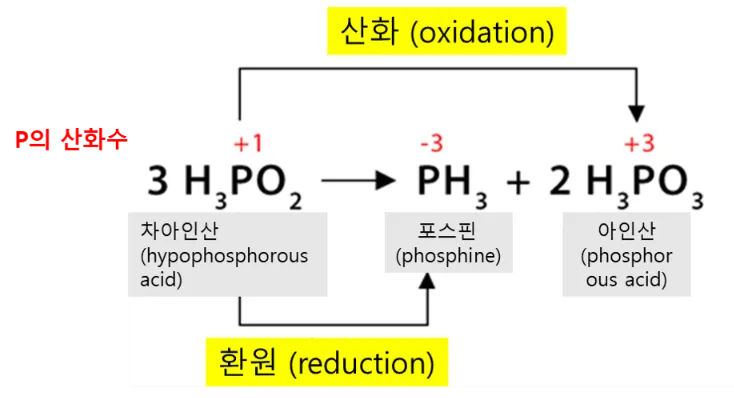
하이포아인산(차아인산)의 분해 반응
강산인 차아인산(H3PO2, hypophosphorous acid)은 분해되어 무색의 기체인 포스핀(phosphine gas, PH3)과 아인산(phosphorous acid, H3PO3)을 생성하는데요, 이 반응 역시 인의 산화수를 살펴보면 불균등화 반응임을 알 수 있습니다.
3H3PO2 → PH3 + 2H3PO3
이 반응에서 인(P)의 산화수를 살펴보면 아래와 같습니다.
- H3PO2에서 P의 산화수 : +1
- PH3에서 P의 산화수 : -3, 따라서 P의 산화수가 +1에서 -3으로 감소하였으므로 환원되었습니다.
- H3PO3에서 P의 산화수 : +3, 따라서 P의 산화수가 +1에서 +3으로 증가하였으므로 산화되었습니다.
위에서 언급된 세 가지 반응 외에도 불균등화 반응의 사례는 아래와 같이 더 있습니다. 산화수를 따져보고 산화수의 증감을 비교해 보면 왜 불균등화 반응인지 알 수가 있을 것입니다.
- 3HOCl → 2HCl + HClO3
- Cl2 + 2NaOH → NaCl + NaClO + H2O
- Hg2Cl2 → Hg + HgCl2
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
'과학' 카테고리의 다른 글
| 아이오딘화납 앙금생성반응과 일정성분비의 법칙 (1) | 2023.11.30 |
|---|---|
| 염화코발트 색상변화 반응식 (0) | 2023.11.30 |
| 프로판 완전연소반응 생성되는 물의 양 구하는 방법 (0) | 2023.11.29 |
| 전류와 전압에 대한 기초 (0) | 2023.11.29 |
| 손실전력 계산 방법 및 손실전력을 줄이는 방법 (0) | 2023.11.28 |



댓글