염화나트륨의 전기 전도성
염화나트륨(NaCl)은 이온결합물질이죠. 염화나트륨은 고체 상태에서는 양이온(Na+)과 음이온(Cl-)이 서로 단단하게 결합을 형성하고 있으므로 자유롭게 움직일 수가 없고 따라서 전기 전도성이 없습니다. 반면에 액체 상태에서는 양이온인 나트륨 이온(Na+)과 음이온인 염화 이온(Cl-) 사이에 결합이 약하게 형성되어 있기 때문에 이온들이 비교적 자유롭게 이동할 수 있으며 따라서 전기 전도성을 나타내게 됩니다. 우리는 여기서 이온의 이동이 전하를 운반할 수 있으므로 양이온과 음이온의 정전기적 인력으로 결합을 형성하고 있는 이온 결합 물질의 경우에 액체 상태에서 전기 전도성이 있다는 것으로 이해를 하면 되겠죠. 이온 수용액에 전류가 흐르는 이유에 대해서는 아래 글을 참조하시기 바랍니다.
2023.11.17 - [과학] - 이온 수용액에 전류가 흐르는 이유
이온 수용액에 전류가 흐르는 이유
전류의 이동은 전하의 이동 전하라고 하는 것은 물질에 존재하는 +와 -의 성질을 띠는 입자들을 말하는 것으로, 우리가 익히 알고 있다시피 원자핵은 + 전하를, 전자는 - 전하를 가지고 있습니다.
jcspirit.tistory.com
염화나트륨 용융액의 전기 분해
액체 상태인 염화나트륨 용융액(Molten NaCl)에 전기 에너지를 가해주면 물이 전기 분해(electrolysis)되어 성분 물질인 산소 기체와 수소 기체로 분리된 것과 마찬가지로 전자를 잃거나 얻는 반응, 즉 산화와 환원이 일어나므로 염화나트륨이 성분 물질로 분해가 됩니다. 이를 관찰해 보면 수소와 산소가 화학 결합을 통해 물을 생성할 때 전자가 관여하는 것처럼 나트륨과 염소가 화학 결합을 형성할 때 전자가 관여한다는 것을 알 수가 있죠.
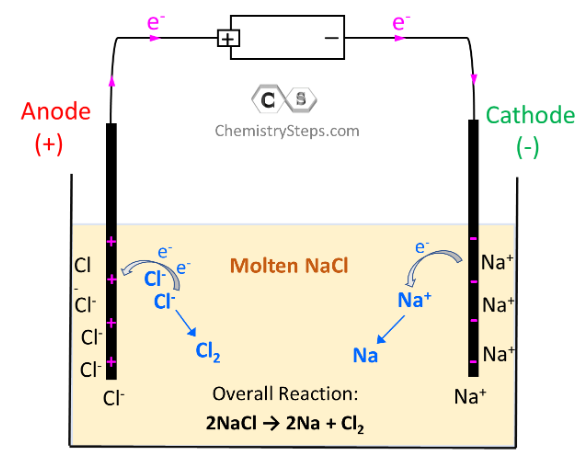
반대 전하끼리는 서로 인력이 작용하므로 나트륨 이온(Na+)은 음극(Cathode)을 둘러싸게 되고 염화 이온(Cl-)은 양극(Anode)을 둘러싸게 됩니다. 전자는 음극에서 양극으로 이동하므로, Na+ 이온은 전자를 얻어서 Na 금속을 환원이 됩니다. 반면에 양극에서는 Cl- 이온의 전자를 끌어당기게 되므로 염화 이온이 전자를 잃는 산화 반응이 일어나게 됩니다. 따라서 (-) 극에서는 금속 나트륨(Na)이 생성되고, (+) 극에서는 염소 기체(Cl2)가 발생하게 됩니다. 이렇게 각 전극에서 발생하는 반응은 아래와 같이 정리할 수 있습니다.
- (-)극 (Cathode) : 2Na^(+) + 2e^(-) → 2Na : 나트륨 이온(Na+)이 전자를 얻어 나트륨(Na) 생성 (환원)
- (+)극 (Anode) : 2Cl^(-) → Cl2 + 2e^(-) : 염화 이온(Cl-)이 전자를 잃어 염소 기체(Cl2) 발생 (산화)
따라서 전체 반응식은 아래와 같이 됩니다.
2NaCl → 2Na + Cl2
물의 전기 분해 반응은 아래 링크를 참고하면 됩니다.
2023.12.15 - [과학] - 물의 전기 분해 (electrolysis)
물의 전기 분해 (electrolysis)
일전에 아래와 같이 라부아지에의 물 분해 실험에 대해 포스팅한 바 있습니다. 그 당시의 실험을 통해 물은 그 자체가 원소가 아니라 수소와 산소로 분해되는 것을 알 수가 있었는데요, 물에 전
jcspirit.tistory.com
'과학' 카테고리의 다른 글
| 정전기 유도 현상과 검전기 (0) | 2023.12.20 |
|---|---|
| 밀도와 비중의 개념 (0) | 2023.12.19 |
| 별의 진화 과정 (0) | 2023.12.19 |
| 마찰 전기의 개념 (정전기) (0) | 2023.12.19 |
| 별의 탄생 과정과 주계열성 (0) | 2023.12.18 |




댓글