0.1M 황산 구리(Ⅱ) 수용액 만들기
준비물 : 황산구리(Ⅱ) 오수화물, 저울, 비커, 증류수, 부피 플라스크, 스포이트
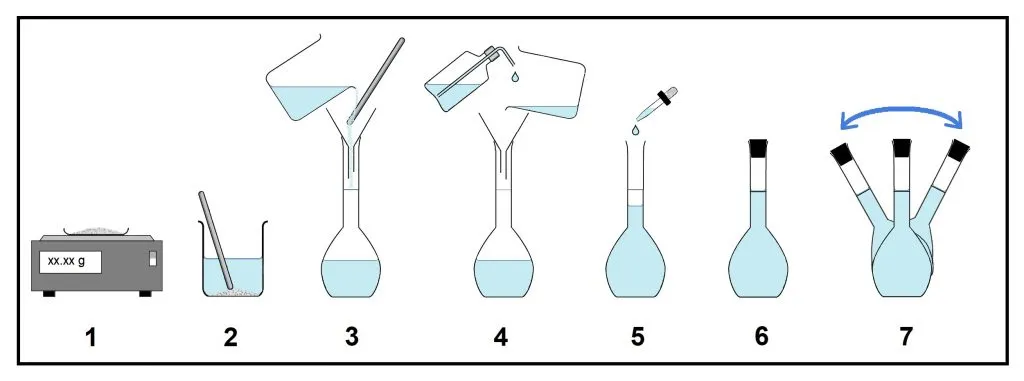
1. 황산구리 오수화물의 화학식량 구하기
황산 구리 오수화물의 분자식은 CuSO4-5H2O이므로, 각 원소의 원자량으로 계산된 화학식량은 아래와 같습니다. 아래 부분은 실험을 하든, 문제를 풀든 사전에 주어지고, 주어지는 값에 맞게 계산을 하면 됩니다.
원자량 : Cu : 63.5, S : 32, O : 16, H : 1
황산 구리 오수화물의 화학식량 : 63.546 + 32 + (16 x 4) + 5 x (1 x 2 + 16) = 249.5
2. 황산구리 0.1mol 계량
황산 구리 오수화물 24.95g을 저울에 계량한 다음, 약간의 증류수를 부어 모두 녹입니다.
1몰의 질량은 화학식량 뒤에 g을 붙인 값과 같고, 물질의 양(mol)은 물질의 질량(g)을 물질의 몰 질량(g/mol)으로 나눈 것이기 때문에, 황산구리 오수화물 24.95g을 계량한 것은 바로 황산구리 오수화물 0.1 mol을 계량한 것입니다.
3. 증류수에 녹인 황산구리 오수화물 수용액, 즉 황산구리 수용액을 비커에서 1L 부피 플라스크에 옮겨 넣습니다.
4. 스포이드나 씻기병(Wash Bottle)으로 증류수를 넣어서 1L 부피 플라스크의 눈금선에 맞춥니다.
몰 농도(M)는 용액의 단위 부피(L) 당 용질의 양(mol)이므로, 아래와 같이 계산됩니다.
- 몰 농도(M) = 용질의 양(mol) / 용액의 부피(L)
따라서, 0.1몰의 황산구리가 녹아 있는 용액의 전체 부피가 1L가 되도록 맞춰주는 것입니다. 참고로, 1 mol에 들어 있는 입자의 숫자는 아보가드로수인 6.02 x 10^23개로 물질의 종류에 관계가 없기 때문에 몰 농도가 같다면 용질의 종류와 관계없이 동일한 부피에 용해되어 있는 입자의 수가 같다는 점, 용액의 부피는 온도에 따라 달라질 수 있으므로 몰 농도는 온도에 따라 달라질 수 있다는 점을 기억해야 합니다. 특히, 용액 100g에 녹아 있는 용질의 질량(g)을 백분율로 나타내는 퍼센트 농도는 온도나 압력에 의한 영향이 없이 일정한 값을 가지는 반면에, 용액의 부피가 온도에 따라 달라지는 점 때문에 몰 농도는 온도에 따라 변할 수가 있으므로, 특정 몰 농도의 용액을 제조할 때는 가급적 온도를 일정하게 유지해 주거나, 제조 전의 온도와 제조 후의 온도를 최대한 같도록 해주어야 합니다.
5. 1L 부피 플라스크의 마개를 막고 잘 흔들어서 섞어 줍니다.
0.1M 황산 구리 수용액이 제조되었습니다.
'과학' 카테고리의 다른 글
| 해양 산성화 반응 정리 (0) | 2023.11.10 |
|---|---|
| 일상 생활 속의 중화반응 (Neutralization reaction) (0) | 2023.10.10 |
| 철의 산화 반응 (철의 녹슬음과 핫팩) (0) | 2023.10.06 |
| 산화환원반응 산화수로 완성시키는 방법 (0) | 2023.10.05 |
| 염화칼슘 용해열 측정 실험 (0) | 2023.10.05 |




댓글