분말 소화기 약제
분말로 된 소화기 약제에는 여러 가지 성분이 들어 있습니다만, 그중에 대표적인 것이 탄산수소나트륨(sodium bicarbonate)입니다. 이 물질은 사실 우리에게 상당히 익숙한 물질로, 흔히 말하는 베이킹 소다가 이것이죠. 우리가 그냥 소다라고 부르기도 하는 물질입니다. 참고로, 탄산수소나트륨은 양쪽성 물질이고, 염기로 작용할 수 있기 때문에 김치나 레몬주스의 신 맛을 줄일 수가 있다는 것은 이전의 포스팅에서 정리한 바가 있습니다.
2023.11.15 - [과학] - 김치의 신맛을 줄이기 위해 소다를 넣는 반응
김치의 신맛을 줄이기 위해 소다를 넣는 반응
김치의 신맛 이유 신맛이 나는 것은 산성 물질의 특성 중의 하나인데요, 신김치 역시 마찬가지로 산성 물질이 있기 때문에 신맛이 납니다. 신 김치의 신맛은 바로 젖산(lactic acid) 때문인데요, 소
jcspirit.tistory.com
불을 끄는 소화기에 탄산수소나트륨이 주성분으로 들어가는 이유가 몇 가지 있는데, 그중 하나는 탄산수소나트륨이 열분해가 되는 반응이 흡열반응이기 때문입니다. 화재 현장에 뿌렸을 때 주변의 열을 흡수하면서 냉각효과가 나타나게 되겠지요. 그리고, 분해되면서 이산화탄소와 수분이 발생하는데요, 이 역시 소화기에 사용되기에 알맞은 특징이겠죠. 이 반응에 대해서 자세히 확인해 보겠습니다.
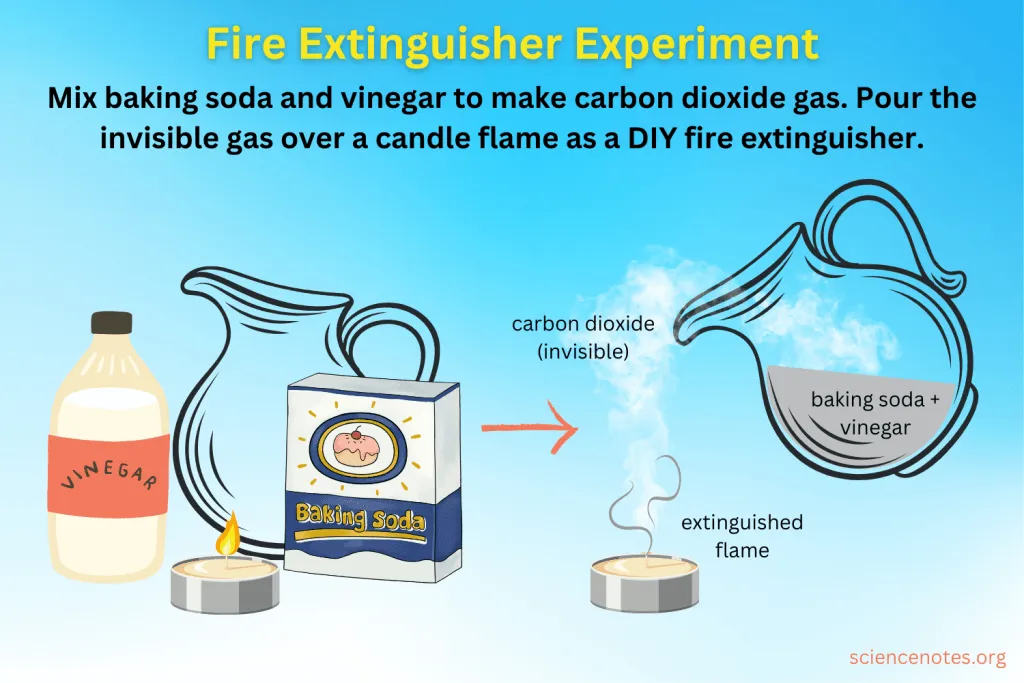
탄산수소 나트륨의 열분해
화학반응이 일어날 때 열을 흡수하는 반응을 흡열반응이라고 하죠. 이러한 흡열반응의 대표적인 예로 탄산수소 나트륨의 열분해를 들 수가 있는데요, 반응식은 아래와 같습니다.
2NaHCO3(s) + 열 → Na2CO3(s) + H2O(l) + CO2(g)
그리고, 위의 반응은 850℃ 이상의 고온에서는 아래와 같이 진행되기도 합니다.
2NaHCO3(s) + 열 → Na2O(s) + H2O(l) + 2CO2(g)
이 반응식을 보면 탄산수소나트륨이 열분해 될 때 열을 흡수하므로, 불에 뿌리게 되면 주변을 냉각시키는 효과가 발생한다는 점, 그리고 물과 이산화탄소가 생성이 되므로 이 역시 불을 끄는데 효과적으로 작용할 수 있다는 점을 알 수 있습니다. 사실 베이킹소다로 빵을 만들 때 빵이 부풀어 오르는 것도 이렇게 생성되는 이산화탄소에 의한 것입니다. 그리고, 우리는 반응식을 알게 되었으므로, 탄산수소나트륨 몇 g을 소화 분말에 사용하였을 때 물(수증기)과 이산화탄소가 얼마나 생성이 될지 알 수가 있고, 온도와 기압을 알면 부피까지 알 수가 있습니다.
참고로, 소화기에 탄산수소나트륨을 황산(H2SO4)과 함께 충진한 다음, 화재 현장에서 소화기를 뒤집어서 서로 섞은 후에 방사하는 타입도 있습니다. 이런 경우에 반응식은 아래와 같이 됩니다.
2NaHCO3(s) + H2SO4(aq) → NaSO4(s) + 2H2O(l) + 2CO2(g)
이러한 유형의 소화기는 산-알칼리 소화기라고도 하는데요, 이렇게 하면 반응의 생성물인 물과 이산화탄소가 소화기로부터 방사되고, 미반응된 탄산수소나트륨이 방사되면 또 열분해가 진행되므로 소화 효과가 나타납니다.
'과학' 카테고리의 다른 글
| 소비전력과 전력량 (Power consumption and wattage) (0) | 2023.11.22 |
|---|---|
| 태양계 행성의 크기 및 질량 순서 (0) | 2023.11.22 |
| 흡열 반응의 예 5가지 (0) | 2023.11.21 |
| 질산암모늄 용해 반응 (아이스팩 원리) (0) | 2023.11.21 |
| 발열반응의 예 4가지 (2) | 2023.11.20 |




댓글