동위원소 (Isotope)
동위원소란 양성자수가 같아 원자 번호는 같으나 중성자수가 다르기 때문에 질량수가 다른 원소를 뜻합니다. 원자 번호는 양성자수로 정해지고, 질량수는 양성자수와 중성자수의 합으로 정해지기 때문입니다.
- 원자번호 (atomic number) = 양성자 수 (proton) = 전자수 (electron)
- 질량수 (mass number) = 양성자 수 (proton) + 중성자 수 (neutron)
따라서 동위원소들은 화학적 성질은 거의 흡사하나 밀도나 끓는점 등의 물리적인 성질이 일부 다르게 되는데요, 수소의 동위원소를 예로 들어보면 아래 이미지와 같습니다.
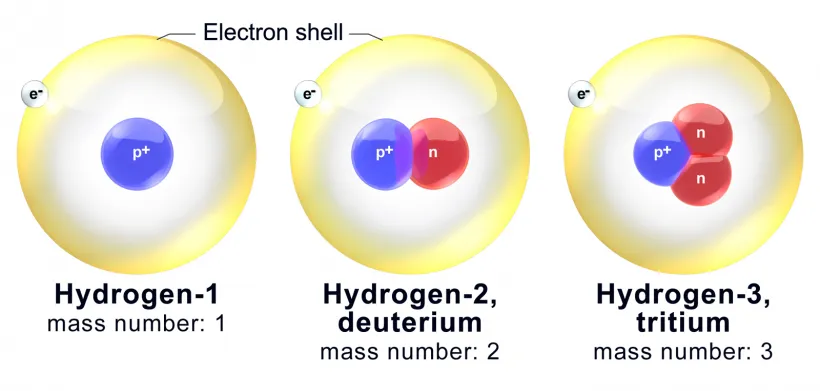
위와 같이 수소, 중수소, 삼중수소를 보면 양성자수는 모두 하나로 동일하나 중성자수가 0개, 1개, 2개로 다르기 때문에 질량수(mass number)가 1, 2, 3으로 다르게 됩니다.
동위원소의 평균원자량 구하는 방법
평균원자량은 자연계에 동위원소가 일정 부분 존재하기 때문에 이를 반영하여 평균값으로 나타낸 원자량을 말하며, 아래와 같이 구할 수가 있습니다.
평균원자량 = Σ (동위원소의 원자량 x 동위원소의 존재 비율)
예를 들어서 염소(Cl)가 자연계에 동위 원소의 비율이 아래와 같이 존재한다고 하면 염소의 원자량을 어떻게 구하는지 예를 들어 보겠습니다.
| 동위원소 | 원자량 | 존재 비율(%) |
| 35Cl | 34.97 | 75.77 |
| 37Cl | 36.97 | 24.23 |
위의 염소의 동위원소와 존재 비율을 나타낸 표에 기입된 수치를 바탕으로 원자량과 존재 비율을 곱한 다음에 더해줍니다.
34.97 x 75.77/100 + 36.97 x 24.23/100 = 35.45
따라서 염소(Cl)의 평균원자량은 35.45가 됩니다. 만약에 평균원자량을 알고 각 동위원소의 존재비율을 알고 있다면 특정 동위 원소의 원자량도 계산을 할 수가 있겠죠. 그리고 평균 분자량을 구할 때는 분자량이 성립할 수 있는 모든 경우의 수를 고려하여 계산을 하면 됩니다. 평균 원자량과 혼동하지 않아야 하는데요, 예를 들어 원소 X의 동위원소가 Xa, Xb 두 가지라면 X2의 평균 분자량을 구할 때 Xa 두 개, Xb 두 개, 그리고 Xa + Xb로 이루어지는 경우가 있으므로 이 경우들을 모두 반영하면 됩니다. 아래 링크를 참고하시기 바랍니다.
2023.12.06 - [과학] - X2 분자량 및 존재비
X2 분자량 및 존재비
X2의 분자량이 세 가지라면 만약 동위원소로 인해서 X2 분자의 분자량이 세 가지라면 동위원소는 두 가지가 존재하게 됩니다. 동위원소 두 가지의 원자량 a, b가 있다면 X2 분자가 형성될 수 있는
jcspirit.tistory.com
'과학' 카테고리의 다른 글
| 물의 자동이온화반응과 이온화 상수 (Kw) (0) | 2023.12.06 |
|---|---|
| X2 분자량 및 존재비 (0) | 2023.12.06 |
| 용해도와 용질의 석출 (0) | 2023.12.04 |
| 기체의 용해도와 잠수병 원인 (0) | 2023.12.04 |
| 연주시차로 별까지 거리 구하는 방법 (0) | 2023.12.02 |



댓글