동적 평형
화학반응에서 동적 평형(Dynamic equilibrium)이란 정반응과 역반응이 모두 일어날 수 있는 가역반응(reversible reaction)에서 정반응 속도와 역반응 속도가 같아 겉보기에 변화가 일어나지 않는 것처럼 보이는 상태를 말합니다. 조금 풀어서 설명을 해보자면 반응이 진행되면서 반응물과 생성물의 농도 변화가 균형을 이루어 변화가 없는 것처럼 보이는 것인데요, 이는 크게 상평형, 용해 평형, 화학 평형의 3가지 평형으로 나눌 수가 있습니다.
상평형
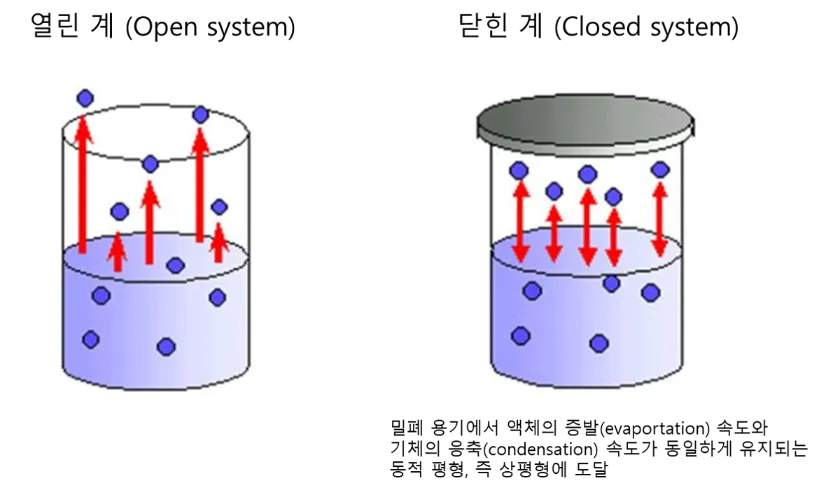
상평형(Phase equilibrium)은 고체, 액체, 기체의 상이 변화되면서 마치 변화가 일어나지 않는 것처럼 보이지만 실제로는 두 상이 변화하는 반응 속도가 같아서 두 가지 상이 서로 공존하는 상태를 말합니다. 예를 들어서, 액체의 증발 속도와 기체의 응축 속도가 같으면 겉보기에는 아무런 변화가 없는 것처럼 보이지만 실제로는 증발과 응축이 계속 진행되고 있으며 액체의 증발 속도와 기체의 응축 속도가 일정하게 유지되고 있는 것입니다. 아래 상평형의 예를 보면 훨씬 수월하게 이해가 될 것입니다.
밀폐 용기에서 물의 증발과 응축 (evaportation and condensation)
일정한 온도에서 밀폐 용기에 물을 담아 둔다면 물의 양이 차츰 줄어드는 것을 관찰할 수가 있는데 어느 시점이 지나면 물이 줄어들지 않고 일정한 양이 유지가 됩니다. 여기서 밀폐 용기라는 것은 닫힌 계, 즉 closed system을 의미하는 것입니다. 그리고, 어느 시점부터 이렇게 일정한 양의 물이 유지되는 이유는 물의 증발 속도가 수증기의 응축 속도가 같아지면서 동적 평형 상태에 도달하였기 때문입니다. 참고로, 열린 용기에서는 물의 증발 속도가 수증기의 응축 속도에 대비하여 빠르기 때문에 물이 모두 증발하게 되므로 동적 평형에 도달하지 않습니다. 공기 중으로 증발된 물(수증기)이 확산되기 때문이죠. 이런 경우를 열린계, open system이라고 하게 됩니다.
H2O(l) ⇆ H2O(g)
브로민(Br)의 증발과 응축
마찬가지로 밀폐 용기, 즉 닫힌 계(closed system)에 액체 브로민을 넣어두면 액체 브로민의 증발로 인해 액체 브로민의 양이 점차 줄어들다가 어느 순간부터는 일정한 양을 유지하게 됩니다. 이 역시 액체 브로민의 증발 속도와 기체 응축 속도가 같은 지점에 도달하였기 때문에 동적 평형이 이루어진 것으로 이해할 수 있습니다.
Br2(l) ⇆ Br2(g)
용해 평형
용해 반응이 일어날 때 용질의 용해 속도와 석출 속도가 같으면 겉보기에는 아무런 변화가 일어나지 않는 것처럼 보이게 됩니다. 이 역시 동적 평형에 도달한 것인데요, 예를 들면 설탕을 일정 온도에서 일정량의 물에 계속 넣으면서 용해시키면 어느 순간부터는 설탕이 더 이상 용해되지 않고 석출 되어 가라앉게 됩니다. 아래 용해도의 개념과 연결하면 좀 쉽게 이해가 되겠죠.
2023.12.04 - [과학] - 용해도와 용질의 석출
용해도와 용질의 석출
용해와 용액 한 물질이 다른 물질에 녹아서 섞이는 현상을 용해(dissolution)라고 합니다. 여기서 다른 물질에 녹는 물질을 용질(solute), 다른 물질을 녹이는 물질을 용매(solvent), 그리고 용질이 용매
jcspirit.tistory.com
용해도를 넘어서 설탕이 들어가게 된 것인데, 이는 용매에 용질이 최대로 녹을 수 있는 양까지 용해되어 더 이상 녹지 않는 상태의 포화용액이 된 것이고, 설탕의 용해 속도와 석출 속도가 같은 지점인 동적 평형에 도달한 것입니다.
설탕(용질) + 물(용매) ⇆ 설탕물(용액)
화학 평형
동적 평형 중 화학 평형은 화학 반응이 진행될 때 정반응과 역반응이 같은 속도로 일어나면서 반응물과 생성물의 농도가 일정하게 유지되는 상태를 일컫습니다. 화학 평형의 의미에서 쉽게 알 수가 있듯이 이 화학 평형은 가역 반응에서만 성립하게 되고 반응물과 생성물이 공존하는 상태가 되겠죠.
사산화이질소(N2O4)의 생성과 분해 반응
적갈색을 띠는 이산화질소(NO2)를 시험관에 넣은 다음 25℃ 실온에 두면 적갈색이 점점 옅어지다가 어느 순간부터 적갈색이 더 이상 옅어지지 않고 색상이 유지되는 시점에 도달합니다. 이는 적갈색인 이산화질소가 서로 결합하여 무색인 사산화이질소를 생성하는 반응과 무색인 사산화이질소가 분해하여 적갈색인 이산화질소를 생성하는 반응이 같은 속도에 도달하면서 동적 평형을 이루기 때문입니다.
2NO2(g) (적갈색) ⇆ N2O4(g) (무색)
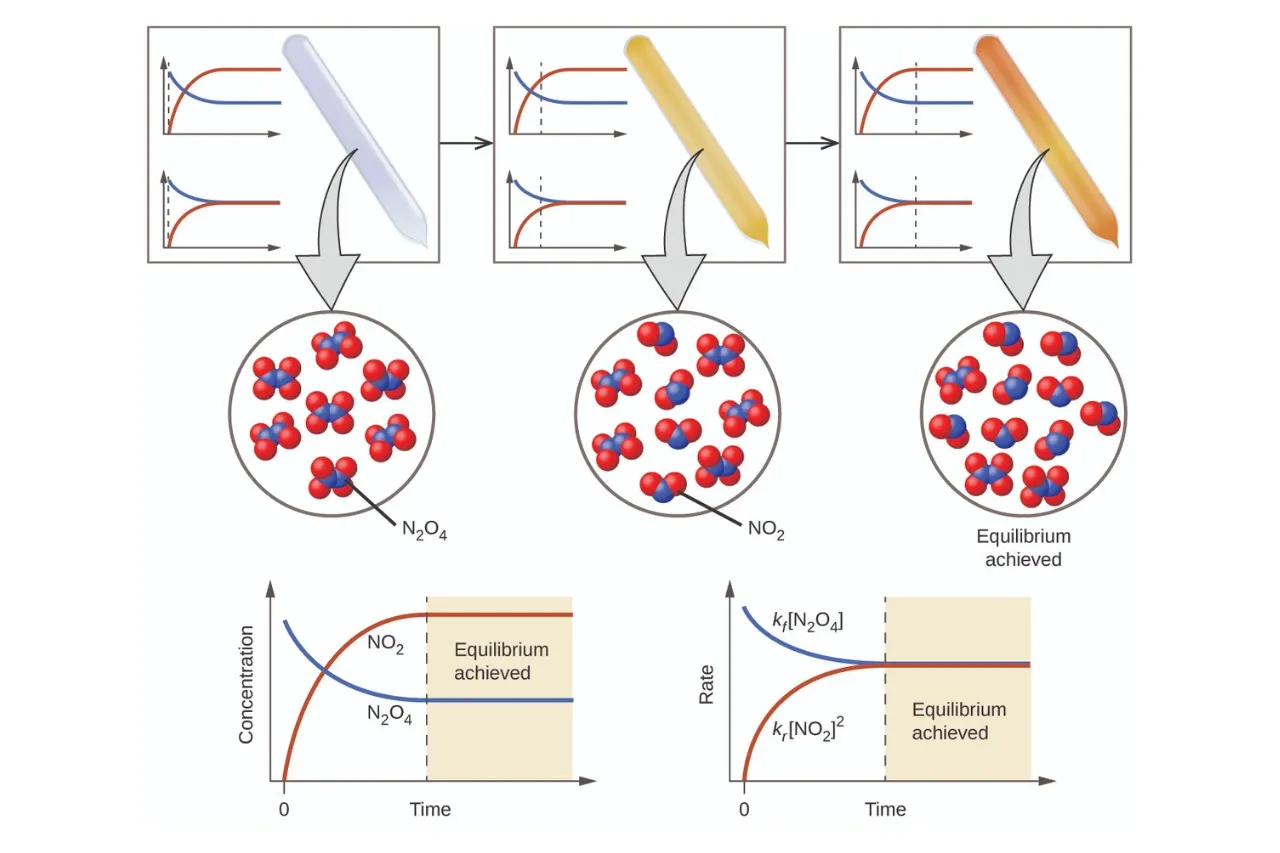
위의 이미지를 보면 사산화이질소(N2O4)를 시험관에 넣어두면 처음에는 무색이었다가 이산화질소(NO2)로 점차 분해되면서 시험관 내부의 색상이 점차 적갈색으로 변화되는 것이 관찰되고, 결국 동적 평형에 이르면 색상이 유지가 됩니다. 분해 반응과 생성 반응의 속도가 동일하게 그래프 상에서 만나는 지점, 즉 동적 평형이 달성된 것입니다.
가역 반응과 비가역 반응의 개념 및 비가역 반응의 예시는 아래 링크를 참조하면 됩니다.
2023.11.20 - [과학] - 비가역 반응의 예 4가지
비가역 반응의 예 4가지
가역 반응과 비가역 반응 (Reversible reaction and Irreversible reaction) 정반응(forward reaction)은 반응물이 생성물로 되는 반응, 역반응(reverse reaction)은 반대로 생성물이 반응물로 되돌아오는 반응을 의미합
jcspirit.tistory.com
'과학' 카테고리의 다른 글
| 수소 이온을 양성자라고 하는 이유 (0) | 2023.12.14 |
|---|---|
| 열의 이동 방법 (전도, 대류, 복사) (0) | 2023.12.14 |
| 마이켈슨 몰리 실험 (에테르 존재 관련) (0) | 2023.12.12 |
| 라부아지에의 물 분해 실험 (0) | 2023.12.12 |
| 저항의 직렬연결과 병렬연결 (Series and Parallel) (0) | 2023.12.11 |




댓글