어떤 학생이 질문을 하여서, 비교적 간단한 내용이긴 하지만 수소 이온을 양성자라고도 하는 이유를 정리해 보겠습니다. 아래의 포스팅을 보면 브뢴스테드-로우리의 산염기 정의에 따라 산과 염기를 양성자를 주는 물질과 받는 물질로 구분할 수 있는데, 왜 양성자와 수소 이온을 동일하게 간주하냐는 질문이었습니다.
2023.11.15 - [과학] - 암모니아가 염기인 이유
암모니아가 염기인 이유
산과 염기 아레니우스(Arrhenius)의 산과 염기에 대한 정의에 따라 일반적으로 아래와 같이 산과 염기를 구분합니다. 산(acid) : 물에 녹아서 수소 이온(H+)을 내놓는 물질 염기(base) : 물에 녹아서 수
jcspirit.tistory.com
수소 이온은 양성자
우리가 익히 알고 있다시피 수소(Hydrogen) 원자는 양성자(Proton) 하나와 전자(electron) 하나로 이루어진 구조를 가지고 있고, 중성자(neutron)는 가지고 있지 않습니다. 그리고, 수소 이온(Hydron, H+, Hydrogen ion)은 수소가 전자를 하나 잃고 형성된 양이온(Cation)을 말하죠. 일단 중수소(Deuterium)나 삼중수소(Tritium) 등 동위 원소의 개념을 제외하고 이야기하고 있는 것입니다. 아래는 수소의 원자 구조입니다.
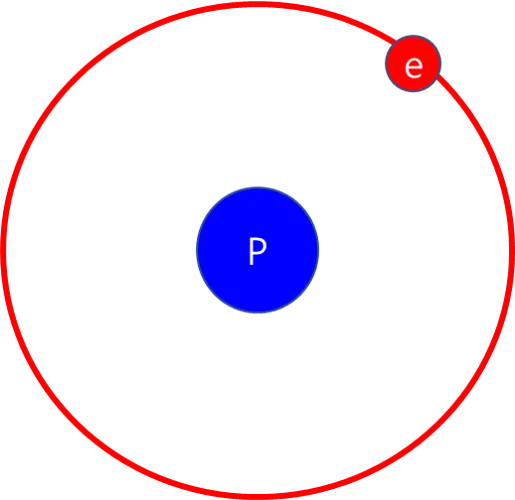
위의 이미지에서 수소 원자가 전자 하나를 잃게 되면 양이온인 수소 이온이 되겠죠. H+가 됩니다. 그런데, 수소 양이온은 오직 양성자(proton) 하나로만 구성이 되어 있게 되므로, 수소 이온과 양성자는 엄밀하게는 다른 개념이지만 수소 이온(H+)을 양성자(Proton)라고도 하게 됩니다.
이제 브뢴스테드(Brnsted-Lowry)의 산 염기 정의에서 양성자를 받는 물질과 양성자를 주는 물질로 구분할 때 수소 이온(H+)이라고 표기되는 이유가 설명이 되겠습니다. 참고로 양성자수는 동일하나 중성자 수가 다른 동위 원소에 대한 내용은 아래 포스팅을 참고하시면 됩니다.
2023.12.05 - [과학] - 동위원소의 평균원자량 구하는 방법
동위원소의 평균원자량 구하는 방법
동위원소 (Isotope) 동위원소란 양성자수가 같아 원자 번호는 같으나 중성자수가 다르기 때문에 질량수가 다른 원소를 뜻합니다. 원자 번호는 양성자수로 정해지고, 질량수는 양성자수와 중성자
jcspirit.tistory.com
'과학' 카테고리의 다른 글
| 물의 전기 분해 (electrolysis) (0) | 2023.12.15 |
|---|---|
| 희석한 용액 몰 농도 구하는 방법 (0) | 2023.12.14 |
| 열의 이동 방법 (전도, 대류, 복사) (1) | 2023.12.14 |
| 동적 평형 예시 (0) | 2023.12.13 |
| 마이켈슨 몰리 실험 (에테르 존재 관련) (0) | 2023.12.12 |



댓글