탄화수소(Hydrocarbon)이라는 것은 탄소(C)와 수소(H)만으로 구성된 유기화합물(Organic compound)을 말하는 것인데, 탄소의 결합 방식에 따라 다양하게 있습니다만, 중고등학생이 간단한 것만 알아도 교과 이해에 큰 도움이 되기에 명명법(Nomenclature) 관련 내용 중 탄소의 개수에 따른 그리스어 접두어에 대한 것을 정리해 보려고 합니다.
우선, 알케인(Alkane, 알칸)은 탄소 원자 사이의 결합이 모두 단일 결합(single bond)이면서 포화(Saturated)된 형태를 말하는 것으로 교과서에도 자주 등장하는 Methane(CH4, 메테인, 메탄), Ethane(C2H6, 에테인, 에탄), Propane(C3H8, 프로페인, 프로판) 등을 말합니다.
여기서 알케인(알칸)을 명명할 때 아래와 같이 그리스어 접두사에 에인(안, ane)을 붙여주면 됩니다.
| 탄소 수 | 접두어 | 접두어 |
| 1 | metha | 메타 |
| 2 | etha | 에타 |
| 3 | propa | 프로파 |
| 4 | buta | 뷰타(부타) |
| 5 | penta | 펜타 |
| 6 | hexa | 헥사 |
| 7 | hepta | 헵타 |
| 8 | octa | 옥타 |
| 9 | nona | 노나 |
| 10 | deca | 데카 |
자, 그러면 탄소수가 1인데 알케인이면 metha + ane으로 methane(메테인, 메탄)이 되는 것입니다. 이제 아래와 같이 사슬형 알케인 탄화수소를 정리할 수 있겠죠. 눈치를 챈 분들은 알겠지만 기본 분자식이 CnH(2n+2)가 됩니다. 고리형(Cyclo) 알케인은 CnH2n의 형태가 되고요.
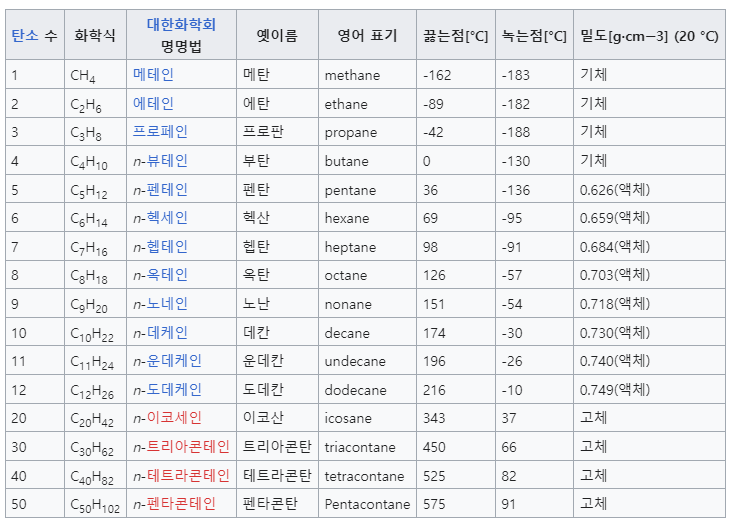
여기서 좀 확장하면 알케인(Alkane)이 아니더라도 이중결합이나 삼중결합이 있는 알켄(Alkene)이나 알카인(Alkyne)과 같은 불포화(unsaturated) 탄화수소도 탄소 수에 따라 마찬가지 명명법을 적용하면 된다는 것을 쉽게 유추할 수 있겠죠. 또한 지방족 화합물(사슬 모양 탄화수소, Aliphatic)이 아니라 고리모양(Cyclo) 탄화수소도 마찬가지입니다. 벤젠과 같은 방향족(aromatic) 탄화수소는 약간 다른 형태가 되는 게 많긴 하네요.
참고로 위의 표에서 탄소수가 많아질수록 녹는점과 끓는점이 높아지는데, 이는 분자량이 커짐에 따라 분자 간의 인력이 커지기 때문입니다. (반데르 발스 힘, van der Waals force)
'과학' 카테고리의 다른 글
| 조흔색의 개념과 광물의 구별 (0) | 2024.03.21 |
|---|---|
| 얼음의 밀도가 물보다 낮은 이유와 물의 밀도가 4℃에서 최대인 이유 (0) | 2024.03.20 |
| 실험 오차 계산 (절대 오차, 상대 오차, 백분율 오차, Percent error) (0) | 2024.03.18 |
| 특수 상대성 이론에서 속도의 한계 (0) | 2024.03.13 |
| 특수 상대성 이론의 두 가지 가정에 대해 (1) | 2024.03.12 |




댓글