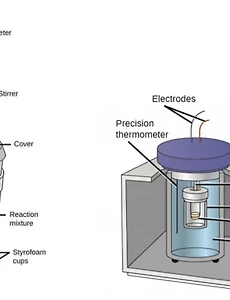
 비열, 열용량, 열량의 개념과 열의 측정 방법
화학반응이 진행될 때 흡열반응과 발열반응과 같이 열의 출입을 동반하게 되는데요, 이때 발생하는 열로 화학반응의 진행을 간접적으로 확인할 수 있을 뿐만 아니라, 이러한 화학반응을 산업적으로 또는 실험실 단위에서의 연구 등 여러 방면으로 이용하기 위해서 열이 얼마나 발생하는지, 그리고 열이 얼마나 흡수가 되는지에 대해 알고 있어야 합니다. 이에 따라 비열, 열용량, 열량의 개념을 정리해 보고 열을 측정하는 방법 역시 확인해 보겠습니다. 비열, 열용량, 열량 비열 (c, specific heat) 어떠한 물질 1g의 온도를 1℃ 높이기 위해 필요한 열량을 뜻하며, 단위는 J/(g℃)가 됩니다. 혹은 어떠한 물질 1kg의 온도를 1℃ 높이는데 필요한 열량으로 Kcal/(kg℃)의 단위를 쓸 수도 있죠. 열량의 ..
2023. 11. 24.
비열, 열용량, 열량의 개념과 열의 측정 방법
화학반응이 진행될 때 흡열반응과 발열반응과 같이 열의 출입을 동반하게 되는데요, 이때 발생하는 열로 화학반응의 진행을 간접적으로 확인할 수 있을 뿐만 아니라, 이러한 화학반응을 산업적으로 또는 실험실 단위에서의 연구 등 여러 방면으로 이용하기 위해서 열이 얼마나 발생하는지, 그리고 열이 얼마나 흡수가 되는지에 대해 알고 있어야 합니다. 이에 따라 비열, 열용량, 열량의 개념을 정리해 보고 열을 측정하는 방법 역시 확인해 보겠습니다. 비열, 열용량, 열량 비열 (c, specific heat) 어떠한 물질 1g의 온도를 1℃ 높이기 위해 필요한 열량을 뜻하며, 단위는 J/(g℃)가 됩니다. 혹은 어떠한 물질 1kg의 온도를 1℃ 높이는데 필요한 열량으로 Kcal/(kg℃)의 단위를 쓸 수도 있죠. 열량의 ..
2023. 11. 24.
 식초속의 아세트산 함량 구하는 방법 (중화적정)
중화적정 중화반응에서 산과 염기가 반응하여 완전히 중화되기 위해서, 산이 내어놓는 수소 이온(H+)의 몰과 염기가 내어놓은 수산화이온(OH-)의 몰이 같아야 합니다. 가수를 n, 몰농도를 M, 부피를 V라고 할 때, 산이 내놓은 수소이온(H+)의 양을 n1M1V1으로, 염기가 내놓은 수산화이온(OH-)의 양을 n2M2V2로 표시한다면 산과 염기가 완전히 중화되는 조건은 아래와 같이 표현할 수 있습니다. n1M1V1 = n2M2V2 참고로 산이나 염기의 가수(n)를 정리해 보면 1가 산은 HCl(염산), CH3COOH(아세트산), 2가 산은 H2SO4(황산), H2CO3(탄산), 3가 산은 H3PO4(인산)이 있고, 1가 염기는 NaOH(수산환나트륨), KOH(수산화칼륨), 2가 염기는 Ca(OH)2(수산..
2023. 11. 23.
식초속의 아세트산 함량 구하는 방법 (중화적정)
중화적정 중화반응에서 산과 염기가 반응하여 완전히 중화되기 위해서, 산이 내어놓는 수소 이온(H+)의 몰과 염기가 내어놓은 수산화이온(OH-)의 몰이 같아야 합니다. 가수를 n, 몰농도를 M, 부피를 V라고 할 때, 산이 내놓은 수소이온(H+)의 양을 n1M1V1으로, 염기가 내놓은 수산화이온(OH-)의 양을 n2M2V2로 표시한다면 산과 염기가 완전히 중화되는 조건은 아래와 같이 표현할 수 있습니다. n1M1V1 = n2M2V2 참고로 산이나 염기의 가수(n)를 정리해 보면 1가 산은 HCl(염산), CH3COOH(아세트산), 2가 산은 H2SO4(황산), H2CO3(탄산), 3가 산은 H3PO4(인산)이 있고, 1가 염기는 NaOH(수산환나트륨), KOH(수산화칼륨), 2가 염기는 Ca(OH)2(수산..
2023. 11. 23.